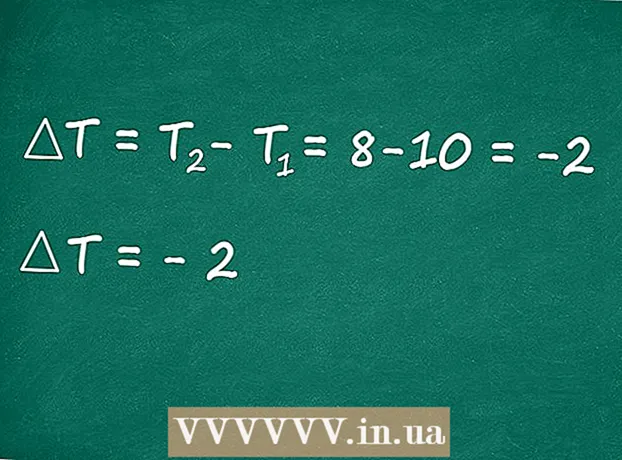Schrijver:
John Pratt
Datum Van Creatie:
11 Februari 2021
Updatedatum:
26 Juni- 2024

Inhoud
- Stappen
- Methode 1 van 3: Enthalpieproblemen oplossen
- Methode 2 van 3: Enthalpie schatten
- Methode 3 van 3: Enthalpie observeren tijdens een experiment
- Tips
Tijdens chemische reacties wordt warmte geabsorbeerd of afgegeven aan de omgeving. Deze warmte-uitwisseling tussen een chemische reactie en de omgeving wordt enthalpie of H genoemd. Het is echter onmogelijk om enthalpie direct te meten, daarom is het gebruikelijk om de verandering in omgevingstemperatuur te berekenen (aangeduid met ∆H). ∆H geeft aan dat tijdens een chemische reactie warmte vrijkomt in de omgeving (exotherme reactie) of warmte wordt geabsorbeerd (endotherme reactie). De enthalpie wordt als volgt berekend: ∆H = m x s x ∆T, waarbij m de massa van reagentia is, s de warmtecapaciteit van het reactieproduct is, ∆T de temperatuurverandering is als gevolg van de reactie.
Stappen
Methode 1 van 3: Enthalpieproblemen oplossen
 1 Identificeer reagentia en reactieproducten. Elke chemische reactie heeft reagentia en reactieproducten. Reactie product is gecreëerd als gevolg van de interactie van reagentia. Met andere woorden, de reagentia zijn de ingrediënten in het recept en het reactieproduct is de afgewerkte schaal. Om de ∆H van een reactie te vinden, moet je de reactanten en reactieproducten kennen.
1 Identificeer reagentia en reactieproducten. Elke chemische reactie heeft reagentia en reactieproducten. Reactie product is gecreëerd als gevolg van de interactie van reagentia. Met andere woorden, de reagentia zijn de ingrediënten in het recept en het reactieproduct is de afgewerkte schaal. Om de ∆H van een reactie te vinden, moet je de reactanten en reactieproducten kennen. - U moet bijvoorbeeld de enthalpie vinden van de reactie van watervorming uit waterstof en zuurstof: 2H2 (waterstof) + O2 (zuurstof) → 2H2O (water). In deze reactie H2 en O2 - reagentia, en H2O - het product van de reactie.
 2 Bepaal het totale gewicht van de reagentia. Vervolgens moet u de massa van de reagentia berekenen. Als u ze niet kunt wegen, bereken dan het molecuulgewicht om het werkelijke te vinden. Molecuulgewicht is een constante die kan worden gevonden in het periodiek systeem of in andere tabellen van moleculen en verbindingen. Vermenigvuldig de massa van elk reagens met het aantal mol.
2 Bepaal het totale gewicht van de reagentia. Vervolgens moet u de massa van de reagentia berekenen. Als u ze niet kunt wegen, bereken dan het molecuulgewicht om het werkelijke te vinden. Molecuulgewicht is een constante die kan worden gevonden in het periodiek systeem of in andere tabellen van moleculen en verbindingen. Vermenigvuldig de massa van elk reagens met het aantal mol. - In ons voorbeeld hebben de reactanten waterstof en zuurstof molecuulgewichten van respectievelijk 2 g en 32 g. Aangezien we 2 mol waterstof gebruiken (de coëfficiënt in de chemische reactie vóór waterstof H2) en 1 mol zuurstof (geen coëfficiënt voor O2 staat voor 1 mol), dan wordt de totale massa van de reagentia als volgt berekend:
2 × (2g) + 1 × (32g) = 4g + 32g = 36 gram
- In ons voorbeeld hebben de reactanten waterstof en zuurstof molecuulgewichten van respectievelijk 2 g en 32 g. Aangezien we 2 mol waterstof gebruiken (de coëfficiënt in de chemische reactie vóór waterstof H2) en 1 mol zuurstof (geen coëfficiënt voor O2 staat voor 1 mol), dan wordt de totale massa van de reagentia als volgt berekend:
 3 Bepaal de warmtecapaciteit van het product. Bepaal vervolgens de warmtecapaciteit van het reactieproduct. Elk molecuul heeft een specifieke warmtecapaciteit, die constant is. Vind deze constante in de tabellen van een scheikundeboek. Er zijn verschillende eenheden voor het meten van de warmtecapaciteit; in onze berekeningen zullen we J / g ° C gebruiken.
3 Bepaal de warmtecapaciteit van het product. Bepaal vervolgens de warmtecapaciteit van het reactieproduct. Elk molecuul heeft een specifieke warmtecapaciteit, die constant is. Vind deze constante in de tabellen van een scheikundeboek. Er zijn verschillende eenheden voor het meten van de warmtecapaciteit; in onze berekeningen zullen we J / g ° C gebruiken. - Merk op dat als u meerdere reactieproducten heeft, u de warmtecapaciteit van elk moet berekenen en deze vervolgens moet optellen om de enthalpie van de gehele reactie te krijgen.
- In ons voorbeeld is het reactieproduct water, dat een warmtecapaciteit heeft 4,2 J / g ° C.
 4 Zoek de verandering in temperatuur. Nu zullen we ∆T vinden - het temperatuurverschil voor en na de reactie. Trek de eindtemperatuur (T2) af van de starttemperatuur (T1). Meestal wordt de schaal van Kelvin (K) gebruikt bij scheikundige problemen (hoewel de schaal van Celsius (° C) hetzelfde resultaat geeft).
4 Zoek de verandering in temperatuur. Nu zullen we ∆T vinden - het temperatuurverschil voor en na de reactie. Trek de eindtemperatuur (T2) af van de starttemperatuur (T1). Meestal wordt de schaal van Kelvin (K) gebruikt bij scheikundige problemen (hoewel de schaal van Celsius (° C) hetzelfde resultaat geeft). - Laten we in ons voorbeeld aannemen dat de initiële reactietemperatuur 185 K was en na de reactie 95 K, wat betekent dat ∆T als volgt wordt berekend:
∆T = T2 - T1 = 95 K - 185 K = -90 K
- Laten we in ons voorbeeld aannemen dat de initiële reactietemperatuur 185 K was en na de reactie 95 K, wat betekent dat ∆T als volgt wordt berekend:
 5 Vind de enthalpie met de formule ∆H = m x s x T. Als m de massa van de reactanten is, s de warmtecapaciteit van het reactieproduct en ∆T de temperatuurverandering is, dan kan de enthalpie van de reactie worden berekend. Vul de waarden in in de formule ∆H = m x s x ∆T en krijg de enthalpie. Het resultaat wordt berekend in Joule (J).
5 Vind de enthalpie met de formule ∆H = m x s x T. Als m de massa van de reactanten is, s de warmtecapaciteit van het reactieproduct en ∆T de temperatuurverandering is, dan kan de enthalpie van de reactie worden berekend. Vul de waarden in in de formule ∆H = m x s x ∆T en krijg de enthalpie. Het resultaat wordt berekend in Joule (J). - In ons voorbeeld wordt de enthalpie als volgt berekend:
∆H = (36 g) × (4,2 JK - 1 g - 1) × (-90 K) = -13608 J
- In ons voorbeeld wordt de enthalpie als volgt berekend:
 6 Bepaal of er tijdens de betreffende reactie energie vrijkomt of wordt geabsorbeerd. Een van de meest voorkomende redenen waarom u ∆H in de praktijk moet berekenen, is om erachter te komen of de reactie exotherm zal zijn (afgifte van warmte en afname van zelf-energie) of endotherm (opname van warmte uit de omgeving en toename van zelf-energie). energie). Als de ∆H-waarde positief is, is de reactie endotherm. Indien negatief, dan is de reactie exotherm. Hoe groter de absolute waarde van ∆H, hoe meer energie er vrijkomt of wordt geabsorbeerd. Wees voorzichtig als je een praktijkexperiment gaat uitvoeren: bij reacties met hoge enthalpie kan een grote hoeveelheid energie vrijkomen, en als het snel gaat, kan het tot een explosie leiden.
6 Bepaal of er tijdens de betreffende reactie energie vrijkomt of wordt geabsorbeerd. Een van de meest voorkomende redenen waarom u ∆H in de praktijk moet berekenen, is om erachter te komen of de reactie exotherm zal zijn (afgifte van warmte en afname van zelf-energie) of endotherm (opname van warmte uit de omgeving en toename van zelf-energie). energie). Als de ∆H-waarde positief is, is de reactie endotherm. Indien negatief, dan is de reactie exotherm. Hoe groter de absolute waarde van ∆H, hoe meer energie er vrijkomt of wordt geabsorbeerd. Wees voorzichtig als je een praktijkexperiment gaat uitvoeren: bij reacties met hoge enthalpie kan een grote hoeveelheid energie vrijkomen, en als het snel gaat, kan het tot een explosie leiden. - In ons voorbeeld is het eindresultaat -13608 J. Er staat een minteken voor de enthalpiewaarde, wat betekent dat de reactie exotherm... Hete gassen (als stoom) H2 en O2 moet wat warmte afgeven om een watermolecuul te vormen, dat wil zeggen, de reactie van de vorming van H2O is exotherm.
Methode 2 van 3: Enthalpie schatten
 1 Bereken de bindingsenergie om de enthalpie te schatten. Bijna alle chemische reacties leiden tot het verbreken van sommige bindingen en de vorming van andere. De energie als gevolg van de reactie komt nergens vandaan en stort niet in: het is de energie die nodig is om deze bindingen te verbreken of te vormen. Daarom kan de verandering in de enthalpie van de gehele reactie vrij nauwkeurig worden geschat door de energieën van deze bindingen op te tellen.
1 Bereken de bindingsenergie om de enthalpie te schatten. Bijna alle chemische reacties leiden tot het verbreken van sommige bindingen en de vorming van andere. De energie als gevolg van de reactie komt nergens vandaan en stort niet in: het is de energie die nodig is om deze bindingen te verbreken of te vormen. Daarom kan de verandering in de enthalpie van de gehele reactie vrij nauwkeurig worden geschat door de energieën van deze bindingen op te tellen. - Beschouw bijvoorbeeld de reactie: H2 + F2 → 2HF. In dit geval is de energie voor het verbreken van de binding in de H2 is 436 kJ / mol, en de energie voor breuk is F2 bedraagt 158 kJ/mol. Ten slotte is de energie die nodig is om een binding te vormen in een HF-molecuul van H en F = -568 kJ/mol. We vermenigvuldigen de laatste waarde met 2, omdat we tijdens de reactie 2 mol HF krijgen: 2 × -568 = -1136 kJ / mol. Voeg de waarden toe:
436 + 158 + (-1136) = -542 kJ / mol.
- Beschouw bijvoorbeeld de reactie: H2 + F2 → 2HF. In dit geval is de energie voor het verbreken van de binding in de H2 is 436 kJ / mol, en de energie voor breuk is F2 bedraagt 158 kJ/mol. Ten slotte is de energie die nodig is om een binding te vormen in een HF-molecuul van H en F = -568 kJ/mol. We vermenigvuldigen de laatste waarde met 2, omdat we tijdens de reactie 2 mol HF krijgen: 2 × -568 = -1136 kJ / mol. Voeg de waarden toe:
 2 Gebruik de vormingsenthalpie om de enthalpie te schatten. De vormingsenthalpie maakt het mogelijk om ∆H te berekenen door de vormingsreacties van reagentia en producten te berekenen. Als je de vormingsenthalpie van de reactieproducten en reagentia kent, kun je de enthalpie als geheel schatten door op te tellen, zoals in het geval van de hierboven besproken energie.
2 Gebruik de vormingsenthalpie om de enthalpie te schatten. De vormingsenthalpie maakt het mogelijk om ∆H te berekenen door de vormingsreacties van reagentia en producten te berekenen. Als je de vormingsenthalpie van de reactieproducten en reagentia kent, kun je de enthalpie als geheel schatten door op te tellen, zoals in het geval van de hierboven besproken energie. - Beschouw bijvoorbeeld de volgende reactie: C2H5OH + 3O2 → 2CO2 + 3H2O. We weten dat de vormingsenthalpie wordt berekend:
C2H5OH → 2C + 3H2 + 0,5O2 = 228 kJ / mol
2C + 2O2 → 2CO2 = -394 × 2 = -788 kJ / mol
3H2 + 1,5 O2 → 3H2O = -286 × 3 = -858 kJ / mol
Nu is het noodzakelijk om de waarden van de hierboven verkregen gevormde stoffen toe te voegen om de enthalpie van de reactie te bepalen: C2H5OH + 3O2 → 2CO2 + 3H2Oh,
228 + -788 + -858 = -1418 kJ / mol.
- Beschouw bijvoorbeeld de volgende reactie: C2H5OH + 3O2 → 2CO2 + 3H2O. We weten dat de vormingsenthalpie wordt berekend:
 3 Vergeet de tekens voor de enthalpiewaarden niet. Bij het berekenen van de vormingsenthalpie, draait u de formule om voor het bepalen van de reactie-enthalpie van het product, en het teken van de enthalpie zou moeten veranderen. Met andere woorden, als u de formule omdraait, zou het enthalpieteken in het tegenovergestelde moeten veranderen.
3 Vergeet de tekens voor de enthalpiewaarden niet. Bij het berekenen van de vormingsenthalpie, draait u de formule om voor het bepalen van de reactie-enthalpie van het product, en het teken van de enthalpie zou moeten veranderen. Met andere woorden, als u de formule omdraait, zou het enthalpieteken in het tegenovergestelde moeten veranderen. - Merk in het voorbeeld op dat de vormingsreactie voor product C2H5OH is andersom geschreven. C2H5OH → 2C + 3H2 + 0,5O2 dat wil zeggen, C2H5OH wordt afgebroken, niet gesynthetiseerd. Daarom is het teken voor de enthalpie in een dergelijke reactie positief, 228 kJ / mol, hoewel de vormingsenthalpie C is2H5OH is -228 kJ/mol.
Methode 3 van 3: Enthalpie observeren tijdens een experiment
 1 Neem een schone bak en giet er water in. Het is niet moeilijk om de principes van enthalpie in actie te zien - het is voldoende om een eenvoudig experiment uit te voeren. Het is noodzakelijk dat het resultaat van het experiment niet wordt beïnvloed door vreemde verontreinigingen, zodat de container moet worden gewassen en gesteriliseerd. Wetenschappers gebruiken speciale gesloten containers, calorimeters genaamd, om enthalpie te meten, maar een glazen beker of kolf is prima voor jou. Vul de container met schoon kraanwater op kamertemperatuur. Het is raadzaam om het experiment in een koele ruimte uit te voeren.
1 Neem een schone bak en giet er water in. Het is niet moeilijk om de principes van enthalpie in actie te zien - het is voldoende om een eenvoudig experiment uit te voeren. Het is noodzakelijk dat het resultaat van het experiment niet wordt beïnvloed door vreemde verontreinigingen, zodat de container moet worden gewassen en gesteriliseerd. Wetenschappers gebruiken speciale gesloten containers, calorimeters genaamd, om enthalpie te meten, maar een glazen beker of kolf is prima voor jou. Vul de container met schoon kraanwater op kamertemperatuur. Het is raadzaam om het experiment in een koele ruimte uit te voeren. - Voor het experiment is het wenselijk om een kleine container te gebruiken. We zullen kijken naar de enthalpie van de reactie van water met Alka-Seltzer, dus hoe minder water wordt gebruikt, hoe duidelijker de temperatuurverandering zal zijn.
 2 Plaats de thermometer in een container. Neem een thermometer en laat deze in een bak met water zakken, zodat de meetgrens voor de temperatuur onder het waterniveau ligt. Meet de thermometer af - dit is de starttemperatuur, T1.
2 Plaats de thermometer in een container. Neem een thermometer en laat deze in een bak met water zakken, zodat de meetgrens voor de temperatuur onder het waterniveau ligt. Meet de thermometer af - dit is de starttemperatuur, T1. - Laten we aannemen dat de watertemperatuur 10°C is. We zullen deze waarde gebruiken om de principes van enthalpie te demonstreren.
 3 Voeg een Alka-Seltzer-tablet toe aan de container. Klaar om de ervaring te beginnen? Gooi een Alka-Seltzer-tablet in het water. Het begint onmiddellijk te borrelen en te sissen. Dit komt door de reactie tussen bicarbonaat (HCO3) en citroenzuur (H). Hierdoor worden water en kooldioxide gevormd volgens de formule: 3HCO3 + 3H → 3H2O + 3CO2.
3 Voeg een Alka-Seltzer-tablet toe aan de container. Klaar om de ervaring te beginnen? Gooi een Alka-Seltzer-tablet in het water. Het begint onmiddellijk te borrelen en te sissen. Dit komt door de reactie tussen bicarbonaat (HCO3) en citroenzuur (H). Hierdoor worden water en kooldioxide gevormd volgens de formule: 3HCO3 + 3H → 3H2O + 3CO2.  4 Meet de eindtemperatuur. Observeer het verloop van de reactie: de Alka-Seltzer-tablet zal geleidelijk oplossen. Als het volledig is opgelost, meet u de temperatuur opnieuw. Het water moet wat kouder worden. Als de watertemperatuur daarentegen hoger werd dan de begintemperatuur, betekent dit dat het experiment werd verstoord door enkele externe factoren (bijvoorbeeld een te warme ruimte waar het experiment werd uitgevoerd).
4 Meet de eindtemperatuur. Observeer het verloop van de reactie: de Alka-Seltzer-tablet zal geleidelijk oplossen. Als het volledig is opgelost, meet u de temperatuur opnieuw. Het water moet wat kouder worden. Als de watertemperatuur daarentegen hoger werd dan de begintemperatuur, betekent dit dat het experiment werd verstoord door enkele externe factoren (bijvoorbeeld een te warme ruimte waar het experiment werd uitgevoerd). - Stel dat de temperatuur nu 8°C is.
 5 Laten we de enthalpie van de reactie berekenen. Wanneer de Alka-Seltzer-tablet reageert met water, worden water en koolstofdioxide gevormd (die zeer bruisende bubbels) en daalt de temperatuur (dit is het resultaat dat zou moeten worden verkregen als het experiment succesvol was). Er kan worden geconcludeerd dat deze chemische reactie endotherm is, dat wil zeggen dat deze gepaard gaat met de absorptie van energie uit de omgeving - in dit geval uit water. Hierdoor daalt de watertemperatuur.
5 Laten we de enthalpie van de reactie berekenen. Wanneer de Alka-Seltzer-tablet reageert met water, worden water en koolstofdioxide gevormd (die zeer bruisende bubbels) en daalt de temperatuur (dit is het resultaat dat zou moeten worden verkregen als het experiment succesvol was). Er kan worden geconcludeerd dat deze chemische reactie endotherm is, dat wil zeggen dat deze gepaard gaat met de absorptie van energie uit de omgeving - in dit geval uit water. Hierdoor daalt de watertemperatuur. - In ons experiment daalde de watertemperatuur met twee graden. Dit is in overeenstemming met de theorie: de oplossingsreactie van "Alka-Seltzer" in water is endotherm en gaat gepaard met een kleine absorptie van energie.
Tips
- Berekeningen gebruiken de Kelvin-schaal (K), een temperatuurschaal die lijkt op de Celsius-schaal en die vaak wordt gebruikt in de scheikunde en natuurkunde. Om Celsius naar Kelvin te converteren, voegt u 273 graden toe of trekt u deze af: K = ° C + 273.