Schrijver:
Lewis Jackson
Datum Van Creatie:
5 Kunnen 2021
Updatedatum:
1 Juli- 2024

Inhoud
Mol is de standaard meeteenheid in de chemie, die wordt gebruikt om naar de verschillende elementen in een verbinding te kijken. Gewoonlijk worden samengestelde massa's berekend in gram (g) en moeten ze worden omgezet in molaire eenheden. De overgang is vrij eenvoudig, maar er zijn nog enkele belangrijke stappen die we moeten volgen. Met behulp van de onderstaande methode kunt u eenvoudig grammen omzetten in mollen.
Stappen
Deel 1 van 2: Bereken molecuulmassa
Bereid de benodigde benodigdheden voor om het rekenprobleem op te lossen. Als u over alle tools beschikt, is het gemakkelijker om het probleem op te lossen. Wat je nodig hebt is:
- Potlood en papier. De wiskunde wordt gemakkelijker als je alles op papier schrijft. U moet alle stappen presenteren om de maximale score te behalen.
- Periodiek systeem van chemische elementen: gebruikt om de massa-atomen van de elementen te bepalen.
- Zakrekenmachine: wordt gebruikt om ingewikkelde getallen te berekenen.

Bepaal welke elementen in de compound zitten die u naar molaire eenheden moet converteren. De eerste stap bij het berekenen van de molecuulmassa is het bepalen van de elementen waaruit de verbinding bestaat. Dit is gemakkelijk omdat de afkorting voor elementen slechts één tot twee tekens lang is.- Als een stof wordt afgekort met twee letters, wordt de eerste letter met een hoofdletter geschreven en de tweede letter in kleine letters. Voorbeeld: Mg is de afkorting voor het element magnesium.
- NaHCO-verbindingen3 bestaat uit vier elementen: natrium (Na), waterstof (H), koolstof (C) en zuurstof (O).
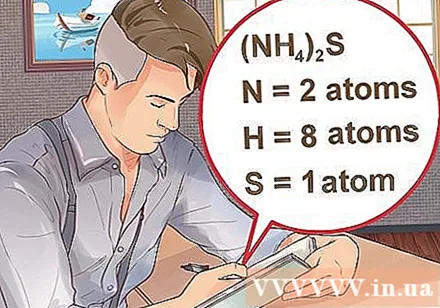
Bepaal het aantal atomen voor elk element in de verbinding. U moet het atoomnummer van elke stof in een verbinding weten om het massamolecuul van die verbinding te berekenen. Het kleine getal naast de initialen van het element staat voor het atoomnummer van het element.- Voorbeeld: verbinding H2O heeft twee waterstofatomen en één zuurstofatoom.
- Als een verbinding tussen haakjes wordt geschreven, vergezeld van een kleine index, betekent dit dat elk ingrediënt tussen haakjes de index vermenigvuldigt. Voorbeeld: verbinding (NH4)2S bestaat uit twee N-atomen, acht H-atomen en één S-atoom.

Schrijf voor elk element het kubieke atomaire papier op. Het periodiek systeem gebruiken is de gemakkelijkste manier om het kubieke atoom van een element te vinden. Nadat u het element in het periodiek systeem hebt gevonden, ziet u de atomaire massa net onder het pictogram van het element.- Het kubieke zuurstofatoom is bijvoorbeeld 15,99.
Bereken de moleculaire massa. Het massamolecuul van een stof is gelijk aan het aantal atomen van elk element vermenigvuldigd met het massa-atoom van dat element. Deze hoeveelheid is essentieel in gram naar molaire conversie.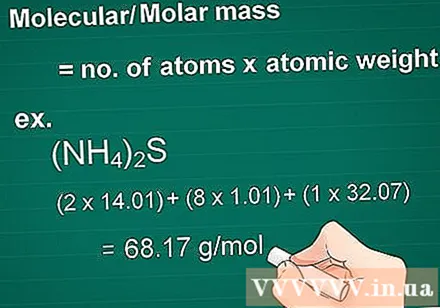
- Vermenigvuldig eerst het atoomnummer van elk element in de verbinding met zijn massa-atoom.
- Voeg vervolgens de massa van de elementen in de compound bij elkaar.
- Voorbeeld: molecuulmassa van een verbinding (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molecuulmassa wordt ook wel molaire massa genoemd.
Deel 2 van 2: Zet gram om in mol
Stel de conversieformule in. Om het aantal mol van de verbinding te vinden, deelt u het aantal grammen van de verbinding door het molecuulgewicht van die verbinding.
- Formule: aantal mol = massa (gram) / molaire massa van verbinding (gram / mol)
Vervang de getallen in de formule. Nadat u de juiste formule hebt ingesteld, is de volgende stap het vervangen van de getallen die u hebt berekend in de formule. Als u zeker wilt weten dat de gegevens op de juiste positie staan, kunt u dit controleren door de eenheid te onderdrukken. Als na eenvoud de resterende eenheid mollen is, bent u correct ingesteld.
Los De vergelijking op. Gebruik een rekenmachine om de massa te delen door het kubieke molecuul van de stof of verbinding. Het quotiënt is het aantal mol van de stof of verbinding die u zoekt.
- Het probleem is bijvoorbeeld voor 2 g water (H.2O) en vraag je om het om te rekenen naar molaire eenheden. We hebben de molaire massa van H2O is 18 g / mol. Deel 2 door 18, dus je hebt 0,1111 mol H2O.
Advies
- Vergeet niet om het element of de samengestelde naam bij de antwoorden op te nemen.
- Als u wordt gevraagd om een oefening of quiz te presenteren, zorg er dan voor dat u uw antwoorden duidelijk laat zien door de antwoorden te omcirkelen of een kader te tekenen.
Wat je nodig hebt
- Chemisch periodiek systeem
- Potlood
- Papier
- Computer
- Chemische problemen



