Schrijver:
Louise Ward
Datum Van Creatie:
11 Februari 2021
Updatedatum:
28 Juni- 2024

Inhoud
De grootte van een atoom is zo klein dat het moeilijk is om het atoomnummer van een chemische verbinding nauwkeurig te meten. Om een hoeveelheid stoffen nauwkeurig te kunnen meten, gebruiken wetenschappers een eenheid mol om een bepaald aantal atomen weer te geven. Een mol stof wordt gedefinieerd als het equivalent van het aantal koolstofatomen in 12 gram van de 12 koolstofisotoop, dat is ongeveer 6.022 x 10 atomen. Deze waarde wordt het Avogadro-getal of de Avogadro-constante genoemd. Dit wordt ook wel het aantal atomen in 1 mol van een element genoemd, en 1 mol van de massa van een stof wordt de molaire massa van die stof genoemd.
Stappen
Methode 1 van 2: Bereken de molaire massa van een element
Definitie van molaire massa. Molaire massa van een stof is de massa (in gram) van één mol van die stof. Om de molaire massa van een element te berekenen, vermenigvuldigt u de atoommassa met de gram-per-mol conversiefactor (g / mol).
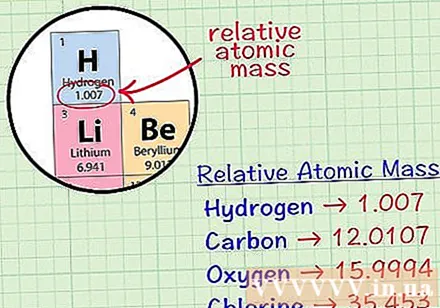
Vind het gemiddelde kubieke atoom van een element. Het atoom met de gemiddelde massa van een element is de gemiddelde massa, in atomaire eenheden, in een monster dat alle isotopen van dat element bevat. Deze informatie wordt vaak gegeven op het periodiek systeem der elementen. Door een element te lokaliseren, kun je een gemiddeld kubisch atoom vinden dat net onder het chemische symbool van het element is geschreven. Deze waarde is geen geheel getal, maar een getal met decimalen.- Met waterstof is het atoom met de gemiddelde massa bijvoorbeeld 1,007; Het gemiddelde kubieke koolstofatoom is 12.0107; De gemiddelde massa zuurstofatoom is 15.9994; chloor heeft een gemiddelde atoommassa van 35.453.

Vermenigvuldig het gemiddelde massa-atoom met de molaire massa-constante. De eenheid van gesmolten massa wordt gedefinieerd als 0,001 kilogram per mol of 1 gram per mol. Het product van het gemiddelde massa-atoom en de molaire massa-constante zet de eenheid van atomaire massa om in gram per mol, dus de molaire massa van waterstof zal 1,007 gram per mol zijn, van koolstof is 12. 0107 gram per mol, zuurstof is 15.9995 gram per mol en dat van chloor is 35.453 gram per mol.- Sommige elementen komen in de natuur voor als moleculen die uit twee of meer van dezelfde atomen bestaan. Dat wil zeggen, als u de molaire massa wilt berekenen van verbindingen die uit meer dan één atoom bestaan, zoals waterstofgas, zuurstofgas of chloorgas, moet u de gemiddelde atoommassa van de verbinding bepalen en deze waarde vermenigvuldigen. met de molaire massa-constante, '' dan '' vermenigvuldigt u het product dat u zojuist hebt gevonden met 2.
- Met H2: 1.007 x 2 = 2.014 gram per mol; voor O2: 15.9994 x 2 = 31.9988 gram per mol; en Cl2: 35.453 x 2 = 70.096 gram per mol.
Methode 2 van 2: Bereken het molecuulgewicht van de verbinding

Bepaal de structuurformule van de verbinding. De structuurformule van een stof geeft het atoomnummer van elk element waaruit die verbinding bestaat. (Deze informatie is beschikbaar in alle naslagwerken). De chemische formule van zoutzuur is bijvoorbeeld HCl; van glucose is C6H.12O6. Met deze structuurformule kunnen we het aantal van elk type atoom bepalen waaruit de betreffende verbinding bestaat.- Waar HCl één waterstofatoom en één chlooratoom heeft.
- Glucosesuiker molecuul C.6H.12O6 heeft 6 koolstofatomen, 12 waterstofatomen en 6 zuurstofatomen.
Bepaal het gemiddelde massa-atoom van elk samenstellend element. Gebruik het periodiek systeem om het atoom met de gemiddelde massa van elk element in de verbinding te vinden. Het atoom met de gemiddelde massa wordt meestal geschreven onder het chemische symbool van het element op het periodiek systeem. Vergelijkbaar met het berekenen van de molaire massa van een element, vermenigvuldig het gemiddelde massa-atoom met 1 gram / mol.
- Het atoom van de gemiddelde massa van de elementen die zoutzuur vormen, is als volgt: waterstof 1.007 g / mol en chloor 35.453 g / mol.
- Het gemiddelde massa-atoom van de elementen waaruit het glucosemolecuul bestaat is: koolstof, 12,017 g / mol; waterstof, 1.007 g / mol; en zuurstof, 15,9995 g / mol.
Bereken de molaire massa van elk samenstellend element. Door het massa-atoom van een element te vermenigvuldigen met het aantal atomen dat het bijdraagt in een verbinding, wordt de gemiddelde massa van het element in de verbinding verkregen.
- In het geval van zoutzuur, HCl, is het molecuulgewicht van het element waterstof 1007 g / mol en dat van chloor 35.453 g / mol.
- In het geval van glucose, C.6H.12O6is de molaire massa van elk element als volgt: koolstof, 12,0107 x 6 = 72,0642 g / mol; waterstof, 1.007 x 12 = 12.084 g / mol; zuurstof, 15,9995 x 6 = 95,9964 g / mol.
Totale molaire massa van de samenstellende elementen. De totale molaire massa van de composteringselementen is de molaire massa van de verbinding.In de vorige stap hebben we de molaire massa van elk element in de verbinding berekend, in deze stap hoeven we alleen al deze waarden bij elkaar op te tellen.
- Molaire massa van zoutzuur is 1.007 + 35.453 = 36.460 g / mol. 36,46 gram is de massa van 1 mol zoutzuur.
- Molaire massa van glucose is 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Dus elke mol glucose heeft een massa van 180,14 gram.
Advies
- Hoewel in de meeste gevallen de gemiddelde massa-atoom wordt geregistreerd tot op 1 deel 1000 (4 decimalen), wordt in laboratoria de molaire massa vaak teruggebracht tot 2 decimalen, soms zelfs minder, voor grote moleculen. Daarom kan in het laboratoriumgeval de molaire massa van zoutzuur worden geschreven als 36,46 gram per mol, voor glucose 180,14 gram per mol.
Wat je nodig hebt
- Chemisch naslagwerk of periodiek systeem der elementen
- Computer