Schrijver:
Marcus Baldwin
Datum Van Creatie:
19 Juni- 2021
Updatedatum:
1 Juli- 2024
Inhoud
- Stappen
- Deel 1 van 2: Bereid de apparatuur voor
- Deel 2 van 2: Voer een experiment uit
- Tips
- Waarschuwingen
- Wat heb je nodig
Watersplitsingsproces (H2O) in zijn bestanddelen (waterstof en zuurstof) met behulp van elektriciteit wordt elektrolyse genoemd. De gassen die worden verkregen als gevolg van elektrolyse kunnen op zichzelf worden gebruikt - waterstof dient bijvoorbeeld als een van de schoonste energiebronnen. Hoewel de naam van dit proces misschien een beetje slim klinkt, is het eigenlijk gemakkelijker dan het lijkt als je over de juiste apparatuur, kennis en een beetje ervaring beschikt.
Stappen
Deel 1 van 2: Bereid de apparatuur voor
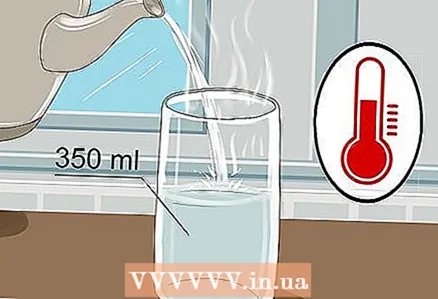 1 Neem een glas van 350 ml en giet er warm water in. Het is niet nodig om het glas tot de rand te vullen, een klein beetje water is voldoende. Koud water is voldoende, hoewel warm water elektriciteit beter geleidt.
1 Neem een glas van 350 ml en giet er warm water in. Het is niet nodig om het glas tot de rand te vullen, een klein beetje water is voldoende. Koud water is voldoende, hoewel warm water elektriciteit beter geleidt. - Zowel kraanwater als flessenwater zijn voldoende.
- Warm water heeft een lagere viscositeit, waardoor ionen zich gemakkelijker kunnen verplaatsen.
 2 Los 1 eetlepel (20 gram) keukenzout op in water. Giet zout in een glas en roer het water om op te lossen. Hierdoor ontstaat een zoutoplossing.
2 Los 1 eetlepel (20 gram) keukenzout op in water. Giet zout in een glas en roer het water om op te lossen. Hierdoor ontstaat een zoutoplossing. - Natriumchloride (d.w.z. keukenzout) is een elektrolyt dat de elektrische geleidbaarheid van water verhoogt. Op zichzelf geleidt water elektriciteit niet goed.
- Nadat u de elektrische geleidbaarheid van het water hebt verhoogd, zal de stroom die door de batterij wordt gecreëerd gemakkelijker door de oplossing gaan en de moleculen effectiever afbreken in waterstof en zuurstof.
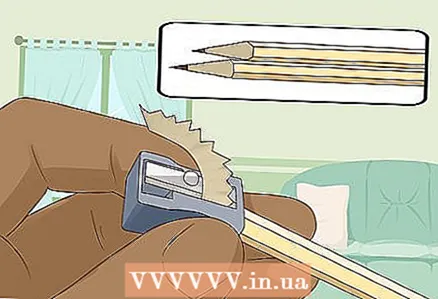 3 Slijp twee hard-zachte potloden aan beide uiteinden om het lood bloot te leggen. Vergeet niet de gum van je potloden te verwijderen. Een grafietstaaf moet aan beide uiteinden uitsteken.
3 Slijp twee hard-zachte potloden aan beide uiteinden om het lood bloot te leggen. Vergeet niet de gum van je potloden te verwijderen. Een grafietstaaf moet aan beide uiteinden uitsteken. - De grafietstaven zullen dienen als geïsoleerde elektroden waarop u de batterij aansluit.
- Grafiet is zeer geschikt voor dit experiment omdat het niet oplost of corrodeert in water.
 4 Knip een stuk karton uit dat groot genoeg is om op het glas te leggen. Gebruik een vrij dik stuk karton dat niet uitzakt nadat je er twee gaten in hebt geponst. Knip een vierkant stuk uit een schoenendoos of iets dergelijks.
4 Knip een stuk karton uit dat groot genoeg is om op het glas te leggen. Gebruik een vrij dik stuk karton dat niet uitzakt nadat je er twee gaten in hebt geponst. Knip een vierkant stuk uit een schoenendoos of iets dergelijks. - Het karton wordt gebruikt om de potloden in het water te houden, zodat ze de zijkanten en onderkant van het glas niet raken.
- Karton is niet geleidend, dus je kunt het veilig op een glas zetten.
 5 Prik met potloden twee gaatjes in het karton. Doorboor het karton met potloden - in dit geval worden ze stevig vastgeklemd en glijden ze niet weg. Zorg ervoor dat het grafiet de zijkanten of onderkant van het glas niet raakt, anders zal het het experiment verstoren.
5 Prik met potloden twee gaatjes in het karton. Doorboor het karton met potloden - in dit geval worden ze stevig vastgeklemd en glijden ze niet weg. Zorg ervoor dat het grafiet de zijkanten of onderkant van het glas niet raakt, anders zal het het experiment verstoren.
Deel 2 van 2: Voer een experiment uit
 1 Sluit een draad met krokodillenklemmen aan op elke accupool. De batterij zal dienen als een bron van elektrische stroom, en via de draden met klemmen en grafietstaven zal de stroom het water bereiken.Sluit een draad met een klem aan op de positieve en de andere op de negatieve pool van de batterij.
1 Sluit een draad met krokodillenklemmen aan op elke accupool. De batterij zal dienen als een bron van elektrische stroom, en via de draden met klemmen en grafietstaven zal de stroom het water bereiken.Sluit een draad met een klem aan op de positieve en de andere op de negatieve pool van de batterij. - Gebruik een 6 volt batterij. Als je er geen hebt, kun je in plaats daarvan een 9-volt batterij gebruiken.
- Een geschikte batterij is verkrijgbaar bij een elektriciteitswinkel of supermarkt.
 2 Verbind de andere uiteinden van de draden met de potloden. Bevestig de metalen draadklemmen stevig aan de grafietstaven. Mogelijk moet u wat meer hout van de potloden afpellen om te voorkomen dat de clips van de grafietstaven glijden.
2 Verbind de andere uiteinden van de draden met de potloden. Bevestig de metalen draadklemmen stevig aan de grafietstaven. Mogelijk moet u wat meer hout van de potloden afpellen om te voorkomen dat de clips van de grafietstaven glijden. - Zo sluit u het circuit en stroomt de stroom van de batterij door het water.
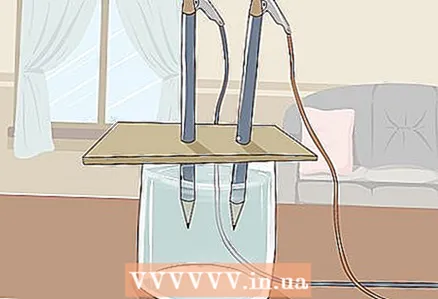 3 Plaats het karton op het glas zodat de vrije uiteinden van de potloden ondergedompeld zijn in het water. Het vel karton moet groot genoeg zijn om op het glas te rusten. Zorg ervoor dat u de juiste plaatsing van de potloden niet verstoort.
3 Plaats het karton op het glas zodat de vrije uiteinden van de potloden ondergedompeld zijn in het water. Het vel karton moet groot genoeg zijn om op het glas te rusten. Zorg ervoor dat u de juiste plaatsing van de potloden niet verstoort. - Om het experiment te laten slagen, mag het grafiet de wanden en bodem van het glas niet raken. Controleer dit nog eens en stel de potloden zo nodig bij.
 4 Kijk hoe het water zich splitst in waterstof en zuurstof. Gasbellen zullen beginnen te stijgen uit de grafietstaven die in het water zijn ondergedompeld. Dit zijn waterstof en zuurstof. Aan de negatieve pool komt waterstof vrij en aan de positieve pool zuurstof.
4 Kijk hoe het water zich splitst in waterstof en zuurstof. Gasbellen zullen beginnen te stijgen uit de grafietstaven die in het water zijn ondergedompeld. Dit zijn waterstof en zuurstof. Aan de negatieve pool komt waterstof vrij en aan de positieve pool zuurstof. - Zodra je de draden op de accu en de grafietstaven aansluit, gaat er een elektrische stroom door het water vloeien.
- Er zullen zich meer gasbellen vormen op het potlood dat is verbonden met de negatieve pool, omdat elk watermolecuul bestaat uit twee waterstofatomen en één zuurstofatoom.
Tips
- Als je geen potloden met grafietschacht hebt, kun je in plaats daarvan twee kleine draadjes gebruiken. Wikkel gewoon het ene uiteinde van elke draad om de bijbehorende accupool en dompel het andere uiteinde in het water. Het resultaat is hetzelfde als met potloden.
- Probeer een andere batterij te gebruiken. De hoeveelheid stroom die vloeit, hangt af van de spanning van de batterij, die op zijn beurt de splitsingssnelheid van watermoleculen beïnvloedt.
Waarschuwingen
- Als je een elektrolyt, zoals zout, aan het water toevoegt, houd er dan rekening mee dat het experiment een kleine hoeveelheid van een bijproduct zoals chloor zal genereren. Het is veilig in zulke kleine hoeveelheden, maar je kunt een lichte chloorlucht ruiken.
- Voer dit experiment uit onder toezicht van een volwassene. Het wordt geassocieerd met elektriciteit en gassen en kan daarom gevaarlijk zijn, hoewel onwaarschijnlijk.
Wat heb je nodig
- Twee hard-zachte potloden
- Een 6 of 9 volt batterij
- Glas met een inhoud van 350 milliliter
- 2 draden met krokodillenklemmen
- Puntenslijper voor potlood
- Zout



